Timus, toraksın ön mediastinum bölgesinde sternumun arka üst kısmına yerleşmiş, yassı, iki loblu primer bir lenfoid organdır. Doğumda yaklaşık 12-15 gramdır ve maksimum büyüklüğüne pubertede (30-40 g kadar) ulaşır. Daha sonra lenfoid parankimin adipoz bağ dokusu ile yer değiştirilmesiyle yavaş bir atrofiye gider. Timus diğer lenfoid organlardan farklı olarak iki farklı germ yaprağından köken alarak gelişir. Timusun lenfositleri mezodermden, epitel taslağı ise endodermden gelişir. Fötal gelişim sırasında, mezenşimden köken alan olgunlaşmamış lenfositler, timus dış korteksindeki endodermden gelişen epitelyal retiküler hücreler arasına göç ederek, timus parankimasını oluşturacak olan öncü T lenfositleri meydana getirir
1.
Timus çevresi dıştan fibröz kapsülle çevrili iki lobdan oluşmuştur ve bu iki lob gevşek bir bağ dokusu ile birbirine tutunmuştur. Kapsül, organın içine septum adı verilen bir takım bölmeler gönderir. Gevşek bağ dokusu yapısında bu septumlar ile timus birbirleriyle bağlantılı lobüllere ayrılır2. Her lobül korteks adı verilen koyu renkli periferik bir bölge ve medulla adı verilen açık renkli merkezi bir bölgeye sahiptir. Korteks küçük lenfositlerden zengin olduğu için medulladan daha koyu boyanır3. İçinde kan damarları taşıyan trabeküller ise korteksin yüzeyinden içe doğru kortikomedullar sınıra kadar uzanırlar. Böylece, kapillerler sadece kortekste yer almaz, medullada da küçük arter ve arterioller bulunur2.
Fonksiyonel timus iki tip hücre popülasyonundan oluşur. Bunlar gelişen T hücreleri ve stromal hücrelerdir. Stromal hücreler; subkapsüler timik epitel hücrelerinden, timik kortikal epitel hücrelerden ve Hassal cisimciğinin yapısına katılan timik medullar epitel hücrelerden, korteks ve medullada bulunan apoptotik T hücrelerinin uzaklaştırılmasında rol alan makrofajlardan ve medullada bulunan kemik iliği orjinli dendritik hücrelerden meydana gelir4.
Epitelyal retiküler hücreler, lenfoid parankimi destekleyen gevşek yapıda bir ağ oluştururlar. Bu hücreler gittikçe incelen uzantılara sahip yassı veya yıldız şeklinde hücrelerdir. Klasik ışık mikroskobu teknikleri ile ayırt edilmeleri zordur, ancak yoğun eozinofilik sitoplazmalı ve belirgin bir çekirdekçiğe sahip, soluk boyanan ovoid çekirdekli hücrelerdir. Timustaki epitelyal retiküler hücrelerin çeşitli görevleri vardır. Bu hücreler T hücre olgunlaşmasını uyaran ve hücre-aracılı immüniteyi sağlayan, timozin ve timopoetin hormonları salgılarlar. Aynı zamanda korteksteki kantimus bariyerini oluştururlar1.
Kortekste gelişen T hücreleri (timosit), makrofaj ve timik kortikal epitelyal retiküler hücreler yer alır. Major histocompatibility complex (MHC) sınıf I ve II molekülleri kortikal epitel hücrelerin yüzeyinde bulunurlar. Korteksteki lenfositler sık bölünürler, medullaya geçerken olgunlaşırlar ve daha sonra timustan ayrılırlar. Medulladaki lenfositler korteksten daha az sayıda ve sık yerleşmiş ancak kortekstekilerden daha büyüktürler4.
Medullada çok sayıda epitelyal retiküler hücre (ERH), makrofaj ve korteksten daha az sayıda lenfosit yer alır. Bu ERHler kortekstekine göre daha az dallanma gösterir1. Medulla korteksten göç eden olgun T lenfositlerinin (single-pozitif) görüldüğü yerdir. Medulada T hücrelerinin maturasyonu tamamlanır ve fonksiyonel T hücreleri postkapiller venüllere geçerek timusu burdan terk eder ve periferal lenfoid organlara göç ederler4. Medullanın kendine özgü ve onu diğer lenfoid organlardan ayıran özelliği, lamellar merkeze sahip küremsi yapılar olan Hassal cisimciklerinin (HC) varlığıdır1.
Hassal cisimciği ilk olarak 1849 yılında Arthur Hill Hassall tarafından timus medullasında bulunan konsantrik asidofilik korpüsküller olarak tanımlanmıştır5. Bu dönemden günümüze kadar HClerin kökeni ve fonksiyonları üzerine çok sayıda çalışmalar yapılmıştır6,7. Timus gelişimi ve ontogenezine yönelik birçok çalışma yapılmasına rağmen HCnin işlevi ve kökeni halen net olarak bilinmemektedir8,9. Timus medullasındaki HCler, yassı nükleusları olan Tip VI epitelyal retiküler hücrelerin desmozom bağlantılarıyla bir araya gelerek konsantrik tabakalar halinde sıkıca paketlenmiş olarak düzenlenmesiyle oluşan yapılardır. Geçirimli elektron mikroskobu (TEM) ile yapılan çalışmalarda HClerin lipid damlacığı, sitoplazmik ara filamanlar ve keratohiyalin granülleri içerdikleri belirlenmiştir9.
Klasik çalışmalar, timus medullasında bulunan HCleri çeşitli büyüklük ve sayılarda olabilen, asidofilik yapılı, merkez kısmında nekrozis, hücresel çöküntü, yoğun kalsifikasyon, kistik oluşumlar gibi büyük dejeneratif değişiklikler gösterebilen ve içerisinde köpüksü makrofajlar ihtiva eden bir yapı olarak tanımlamıştır6,7.
Eski bilgilere göre ise HCler ya ölü timositler için mezarlık alanları ya da medullar timositlerin olgunlaştığı ayrı bir yer olarak nitelendirilmekteydi10,11. Oysa günümüzde HClerin epitel hücrelerinden sitokin ve büyüme faktörü salınımı olduğu yapılan çalışmalarla tespit edilmiştir12. Yeni yapılan çalışmalarla HClerin hücre sinyalizasyonunda, transkripsyonunda ve metabolizmasında aktif rol aldıkları gösterilmiştir13. HCler tarafından üretilen interlökin-4 (IL-4 ) ve interlökin-7 (IL-7) gibi interlökinlerin, T-lenfositlerin eğitimini ve farklılaşmasını sağladıkları düşünülmektedir9.
İnsanlar ve primatlar karşılaştırıldığında, HClerin kemiricilerde daha az sıklıkla bulunduğu belirlenmiştir. Farelerde boyutları çok küçüktür ve immünohistokimyasal boyama yapılmadan gözlenmeleri mümkün değildir. HCler keratin antikoruna karşı güçlü reaksiyon verirken diğer immünohistokimyasal timus epitelyal hücre markırlarına karşı reaksiyon vermez. Fare timusundaki HCler genellikle daha az belirgindir ve merkezlerinde keratin içermezler14.
HC yapılarının hücresel boyutta heterojenlik gösterdiği, ortalama büyüklüğünün 20 - 150 μm arasında olduğu belirlenmiştir1 (Şekil 1). Epitelyal retiküler hücreler HCnin dış tabakasını oluşturmadan önce hipertrofiye uğrarlar15. Daha sonra bu epitelyal retiküler hücreler, birikerek soğan kabuğu benzeri tabakalanma gösterdiği konsantrik organizasyonuyla karakterize HC yapılarını oluştururlar ve bu yapılar medullar timik epitel hücrelerinin farklılaşma evresinin son safhasını temsil ederler6,16. HClerde eksprese edilen involucrinin, bu yapıların medullar timik epitel hücrelerinin farklılaşmalarının son evresinde olduklarının bir göstergesi olduğu düşünülmektedir16.
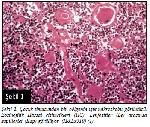
Büyütmek İçin Tıklayın |
Şekil 1: Çocuk timusundan bir bölgenin ışık mikroskobu görüntüsü. Eozinofilik Hassal cisimcikleri (HC). Lenfositler (Le) arasında kapillerler (Kap) görülüyor (H&Ex310)1. |
Günümüz bilgileri, HClerin antijen sunan hücrelerle timik T hücreleri arasındaki haberleşmede rol aldığını gösterir. Timik mikroçevrenin işlevsel komponenti olan HCler intratimik lenfopoezis boyunca parakrin ve justakrin sinyaller vasıtasıyla timositlerin gelişimine, işlevsel olgunluğa ulaşmaları için, yardımcı olmaktadırlar15,17. HClerden IL-7, dönüştürücü büyüme faktörü alfa (TGF-ɑ) , CD30, stromal hücre kökenli faktör-1 (SDF-1) ve makrofaj kökenli kemokin ekspre-se edilir13. Yapılan çalışmalarda, dendritik hücrelerin HC epitel hücreleriyle timositler arasında bağlantı sağladığı gösterilmiştir. HClerin yapısını oluşturan epitel hücreler, timik stromal lenfopoietin (TSLP) ve sitokin benzeri IL-7yi eksprese ederler18. Epitel hücrelerinde TSLPnin klonlanmasıyla ilgili yapılan deneyler ışığında ortaya çıkan bulgular, bu cisimciklerin sadece negatif seleksiyonda değil spesifik alt tip T hücrelerinin farklılaşmasıyla da ilgili olabileceği görüşünü ortaya çıkarmıştır19. İnsan HClerinden salgılanan IL-7, T lenfositlerin gelişiminde önemli rol oynarken, TSLP pozitif immature CD11c miyeloid dendritik hücrelerin güçlü aktivasyonu vasıtası ile dendritik hücrelerin aktivasyonunu sağlar. Aktivasyonu takiben dendritik hücreler MHCII ve dendritik hücre lizozom ilişkili membran proteinini (DC-LAMP) eksprese ederler18. HCnin etrafındaki regülatör T (Treg) hücrelerinin indüklenmesi için peptid-MHCII interaksiyonuna ve CD80, CD86 ya ihtiyaç vardır. Yapılan immünohistokimyasal çalışmalarla CD25+CTLA4+ natural Treglerin aktive dendritik hücreler ve HCden eksprese olan TSLP ile ilişkili olduğu gösterilmiştir. HCler ayrıca dendritik hücreleri aktive ederek Treg üretimini indüklemiş olur. Böylece dendritik hücre aracılığıyla CD4+ CD25+ regülator T hücre üretimine yol açarak selfreaktif T hücrelerinin sekonder pozitif seleksiyonunda kritik role sahip olduğu düşünülmektedir20).
HClerdeki TSLP ekspresyonu, CD80 ve CD86 ekspresyon artışını timik CD11c-pozitif dendritik hücre yoluyla indükler. Timik stromal lenfopoietine bağlı dendritik hücreler CD4+CD8-CD25- timik T hücrelerinin CD4+CD25+FoxP3+ natural Treg hücrelere farklılaşmasını ve çoğalmasını da indükleyebilir20,21. Böylelikle HClerden sentezlenen TSLP indirekt olarak regülatör T lenfosit üretimi sağlamış olmaktadır. Regülatör T lenfositleri de timustaki T lenfositlerin olgunlaşmasının hazırlanmasında önemli rol oynamaktadırlar. HClerden üretilen TSLP nin otoreaktif T lenfositler ve onların fagositozu üzerine etkileri de araştırılmıştır. Bazı durumlarda TSLP nin kararsız T hücrelerinin regülatör T hücrelerine dönüşümünü sağladığı gösterilmiştir. Bu bulgular belki de otoimmün hastalık ve kanserler için daha kesin tedavilere ışık tutabilecektir22.
HClerin hem prenatal hem de yetişkin dönemde timusun fizyolojik aktivitelerine dahil olabileceği bildirilmektedir23. HC hücrelerinin aktif immünolojik fonksiyonları olduğu düşünülmektedir24. Timus morfolojisi üzerine yapılan çalışmalarda immunsüpresif tedavilerin HClerde sayıca azalmaya yol açmış olması da HC ile immün sistem arasında ilişki olduğuna kanıt oluşturmuştur25,26. İmmunoglobulinlerin ve sekretuar fonksiyon yapan komponentlerin varlığı nedeni ile immün yanıtın düzenlenmesi ve olgunlaştırılmasında HCler fizyolojik öneme sahip olabilir24. İnsan timuslarında yapılan immünohistokimyasal çalışmalar sonucunda HClerde immunoglobulinlerin varlığı tespit edilmiştir27,28. HClerde IgE ve IgD ye rastlanılmazken, araştırılan timusların %10 nunda HClerde IgA, IgG ve IgM negatif iken, %60 ında IgA, IgG ve IgM pozitif olarak tespit edilmiştir24.
Raica ve ark.17 tarafından 1 günlük yeni doğan ve 21 yaş aralığında olmak üzere kardiyovasküler malformasyon nedeniyle cerrahi girişim uygulanan 27 hastadan elde edilmiş olan timus dokularında yapılan incelemeler sonucunda HClerin gelişim evreleri juvenil, immature, mature ve senescent (yaşlanan) olmak üzere dört grup halinde tanımlanmıştır (Şekil 2).
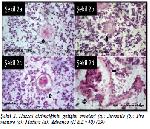
Büyütmek İçin Tıklayın |
Şekil 2: Hassal cisimciğinin gelişim evreleri (a): Juvenile (b): Premature (c): Mature (d): Advance (H &E×40)29 |
Juvenil HClerin belirgin asidofilinin görülmediği, nekroz veya hücresel çöküntüye rastlanılmayan, epitel hücreleri değişime uğramamış düzensiz şekilli, küçük yapılar olduğu bildirilmiştir. İmmature HClerde dejenaratif değişiklikler olmadığı, epitel hücrelerin yassılaşmaya, asidofilik boyanmaya ve yuvarlak bir şekil almaya başladığı tespit edilmiştir. Mature HClerin merkezindeki keratin birikiminin etrafının epitelyal retiküler hücrelerle konsantrik olarak sarılı olduğu gözlenmiştir. Boyutça biraz daha büyüyen mature HClerin merkez bölgesinde nekrotik ve kistik dejeneratif değişiklikler görülmeye başladığı belirlenmiştir. Yassı epitel hücreler periferde dizilim göstermişlerdir. Juvenil ve immatüre HClerde boşluklu bir görünüm yoktur, mature HClerde ise merkezde bir boşluk içerebilir ki bunun ona kistik ve solid bir görünüm kazandırabildiği gözlenmiştir. Yaşlanan HClerin ise boyutça aşırı büyük olup, kistik dilatasyon, hücresel çöküntüler, nekrotik materyal ve kalsifiye alanlar ile karakterize olduğu gösterilmiştir17. Daha sonraki yıllarda Asghar ve ark.29 Raica ve arkadaşlarının17 yaptıkları çalışmaya uyumlu olarak bu HC sınıflamasını teyit etmişlerdir.
Asghar ve ark.30 11 ile 40 hafta arasındaki 28 adet fetüs timusu üzerine histolojik ve morfolojik incelemelerde bulunmuşlardır. HClerin ilk 14. haftada görülmeye başladığını, bu HClerin erken organizasyonunun, biriken dejenere hücreler ve bunların etrafını saran hipertrofik epitelyal retiküler hücreler ile karakterize olduğunu göstermişlerdir. Bu hipertrofik epitelyal retiküler hücreler yassı veya konsantrik dizilim göstermezler. 16-20 haftalar arasındaki fetal HClerin epitelyal retiküler hücrelerinin yassılaşmaya ve konsantrik tabakalar oluşturmaya başladığını fakat tipik HC yapısının halen gözlenmediğini bildirmişlerdir. Hamileliğin 20-24. haftasında HClerin tipik yapısına kavuştuğu; 28. haftada gelişimin atağa kalkarak, 28-30 haftalar arasında HClerin sayıca ve boyutça hızlı bir artışa geçtiği ve başlangıçta birbirine uzak olan HClerin aralarındaki uzaklığın azalarak bir araya geldikleri gözlenmiştir. Son evrede bu HClerin birleşerek çeşitli şekil ve büyüklük gösterdikleri tespit edilmiştir (Şekil 3). Bu yeni HClerin birleşik veya yığılmış gibi bir görünüm sergilediği, birleşen HCler ve bunları saran epitelyal retiküler hücrelerin ise HClerde kemer, çomak, kuyruklu yıldız gibi çeşitli morfolojik şekiller oluşmasını sağladığı bildirilmiştir30.
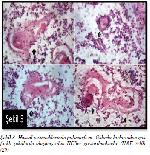
Büyütmek İçin Tıklayın |
Şekil 3: Hassal cisimciklerinde polimorfizm: Oklarla birbirinden çok farklı şekillerde oluşmuş olan HCler gösterilmektedir (H&E ×40)29 |
Epitelyal retiküler hücrelerin keratinizasyon işlemi bir korpüskülden diğerine farklı zamanlarda tetiklenmektedir. HCnin keratinizasyon gelişimi ile büyüklüğü arasındaki ilişkinin açık olmadığı belirlenmiştir. Örneğin bazı küçük HCler yüksek oranda keratinize olurken, çok daha büyüklerde keratinizasyon erken evrelerde görülmektedir. HClerin periferal zonları epitelyal retiküler hücrelerden oluşmakta, merkez ise epitelyal retiküler hücrelerin dejenerasyonu ve keratinizasyonundan elde edilen materyal ve lenfosit gibi bazı hücre tipleri ile dolu olarak izlenmektedir. Medulladaki HCler genel yapı ve içerik bakımından aynıyken, büyüklük ve merkezdeki komponentlerin dejenerasyon dereceleri bakımından farklılık gösterebilmektedirler. Bazı HClerde kısmi veya total lizis gözlenmesinin periferal vakuollerin, kistik veya geniş boşlukların oluşmasına neden olduğu, diğer tip HClerde ise solid yapının korunmakta olduğu bildirilmiştir (Şekil 4). Solid yapı 28. haftadan önce sıklıkla görülürken, kistik yapı ise 28. haftadan sonraki aşamalarda daha çok gözlenmektedir29.
Raica ve ark.31 konjenital kalp rahatsızlığı sonucu cerrahi müdahale geçiren on altı hastadan elde ettikleri timus ile yaptıkları çalışmada, bu vakalardan dördünde seyrek görülen lenfositten zengin HC yapılarını tanımlamışlardır. Bu yapıların preoksidadif stresle indüklenen hızlı timus involüsyonun bir yansıması olabileceği düşünülmüştür. Bu HCler 200 μmnin üzerinde bir büyüklüğe sahiptir ve normal HClere göre daha geniştirler. Bazı vakalarda lenfositlerin yarımay şeklinde korpüskülün içinde kompakt bir yapı oluşturduğu, kimi durumlarda ise lenfosit kümelerinin nekrotik materyalin aralarına dağılmış şekilde görünüm sergilediği gözlemlenmiştir (Şekil 5). Zaman zaman ise lenfositler HClerin geniş kısmını oluştururken, nekrotik materyalin azaldığı görülmektedir. Lenfositlerin HC yapılarının içine nasıl girdiği halen bilinmemektedir31.
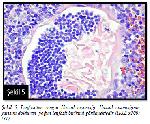
Büyütmek İçin Tıklayın |
Şekil 5: Lenfositten zengin Hassal cisimciği. Hassal cisimciğinin yarısını dolduran yoğun lenfosit birikimi görülmektedir (H&E x200)31. |
Myastina gravis, timus involusyonu ve timomalı hastalarda bu atipik hassal yapısına rastlanmamıştır32.
Hammer33 ise normal ve patolojik timuslarla yaptığı çalışmada, HClerdeki değişiklikleri izlerken, progresif
ve regresif olmak üzere iki tip HC tanımlamıştır. Fakat Asghar ve ark.29 yaptıkları çalışmalarda fetal timusta regresif tipli HClere rastlanılmadığını bildirmişlerdir. Bu farklılığın fetal HClerin aktif olması ve negatif seleksiyonla ilişkili olmasının bir sonucu olarak bu regresyonların önlenmesiyle açıklanabileceğini ileri sürmüşlerdir. Patolojik şartlarda HC tipi tanımlamaları farklılıklar gösterebilmektedir. İmmün yetmezlik ve lenfopeni ile karakterize olan Nezelof sendromu gibi bazı patolojik durumlarda timus yapılarının çok küçük olduğu, timosit sayılarının azaldığı ve HC yapılarının ortadan kaybolduğu görülmüştür34.
Tirozin fosforilasyon sinyalinin timusun gelişiminde anahtar rol oynadığı ortaya konulmuştur. İmmünhistokimyasal analizler sonucunda timus medullasındaki HClerde yüksek oranda tirozin fosforile proteinlerin varlığı tespit edilmiştir23. HClerde tirozin fosforilasyon sinyallerini de içeren src ailesinin lokalizasyonu araştırılmıştır. Src protein tirozin kinaz ailesinin bir üyesi olan p59fyn, ayrıca p50csk ve p130casler ile birlikte hassal cisimciğinin dış tabakasında oldukça fazla ekpre edildikleri, bir diğer üye olan p60c-srcnin ise hassal cisimciğinin iç kısmından eksprese edildiği gösterilmiştir. p59fyn, kerotinosit farklılaşmasının regülasyonuna katılır35. Yapılan elektron mikroskop ve immünohistokimyasal çalışmalarda HCler ile epidermis arasındaki benzerlikleri ortaya konmuştur. Bunun sonucunda keratinositlerde olduğu gibi p59fynun, timik medullar epitel hücre maturasyonunda rol oynayabileceği düşünülmüştür. Bütün bunlar tirozin fosforilasyon sinyalinin timik medulladaki epitel maturasyonunda önemli rol oynayabileceğini ve bu olaylara da src ailesinin de katıldığı görüşlerini destekler niteliktedir23.
HIV ile HCler arasında da ilişki vardır, viral antijen gp120nin HCyi oluşturan epitel hücrelerin etrafında lokalize olduğu, erken evredeki HIV enfeksiyonunda virüsün hedefinin HClerdeki epitel hücreleri olabileceği bildirilmiştir36.
Myastina gravisli hastalarla yapılan çalışmalarda ise timik hiperplaziyle birlikte, HC morfolojisinde farklılığın yanı sıra HClerde sayıca artış olduğu bildirilmiştir37. X ışınlarına maruz bırakılan hayvanlar üzerinde yapılan bir çalışmada ise HClerde sayıca ve boyutça artış olduğu gözlenmiştir38. Başka bir çalışmada sublethal radyasyonun timus mikro çevresinde, medullar timik epitelyal hücre değişimini içeren modifikasyonlara yol açtığı görülmüştür39. Myastina gravisli hiperplastik timusta, timik epitel hücrelerinde HClerdeki de dahil insülin benzeri büyüme faktörü I (IGF-I) üretiminin arttığı ve timusta büyük HClerin varlığı tespit edilmiştir40.
Guinea pig, fare, sıçan gibi hayvanlarda HCler yuvarlak ve küçüktür, şekil ve büyüklük olarak oldukça az polimorfizm gösterirler41. Blau tarafından yapılan bir çalışmada42 guinea piglere düşük doz radyasyon uygulama sonucunda HClerde sayıca ve boyutça bir artış olduğu gözlemlenmiştir.
Timus ve kalbin gelişimi arasında yakından ilişki olması düşüncesiyle, konjenital kalp defektli çocuklarda timusun mikroskobik özelliklerinde (yapısal, sayısal ve şekilsel) herhangi bir değişim olup olmadığının araştırılması planlanmıştır. Atriyal septal defektli hastalarda HCnin normal yapısını koruduğu, ventriküler septal defektli, atrioventriküler septal defektli, fallot tetrolojili, büyük arterlerin transposizyonu olan infant hastalarda ise HClerde yapısal değişiklikler meydana geldiği yapılan çalışmayla ortaya konulmuştur. Bu vakalarda HClerde hücresel kalıntı ile dolan kistik dilatasyonla birlikte genişleme göze çarpan önemli değişimlerdendir. Ventriküler septal defektli hastaların timus medullalarında dev HCler gözlemlenmiştir. Medullada rastlanan daha küçük HC yapılarının yüzeyinde yassı epitel hücre tabakasında artış olduğu belirlenmiştir. Daha büyük HC yapılarında ise tek tabakalı düzleşmiş epitel hücreleri görülmüştür43. Yapılan bir başka çalışmada da konjenital kalp rahatsızlığı olan çocukların timus medullasındaki HC yapılarında değişiklikler olduğu bildirilmiştir. Medullada boyut, sayı ve yapı olarak çeşitlilik gösteren HCler olduğu tespit edilmiştir. Ventriküler septal defektli çocuklara ait timus örneklerinde büyük kistik HCler olduğu, normal timusa ait HC boyutlarıyla karşılaştırıldığında bu hastalarda HC boyutlarının 100-250 μm ye kadar büyüdüğü gözlemlenmiştir. Ayrıca bu hastalarda kontrol grubuna göre HClerde sayıca artış olduğu da rapor edilmiştir.
Medulladaki epitel hücrelerinde de birtakım değişiklikler olduğu belirlenmiştir. Periferal bölgedeki HClerin solgun sitoplazmalı, iki çekirdekçiği olan büyük bir çekirdeğe sahip epitelyal retiküler hücrelerden oluştuğu, merkezdeki epitelyal retiküler hücrelerin ise sitoplazmalarında geniş vakuoller, endoplazmik retikulum sisternalarında dilatasyon olduğu gözlenmiştir. Hiyalinizasyon, kalsifikasyon gibi dejeneratif değişiklikler veya kistik değişiklikler olduğu belirlenmiştir. Bazı HClerde ise kan damar endotel yapısında değişiklikleri içeren spesifik yapılara da rastlanılmıştır44.
Bloom sendromu, telanjiektazik eritem, immün yetmezlik ve artmış kanser riski içermesiyle tanımlanmaktadır. Bloom sendromu geninin organların özel bölgelerinde, örneğin timusun HClerinde eksprese olduğu belirlenmiştir. Yüksek oranda CD30 eksprese ederek immünizasyonda önemli bir rol oynayan timus gibi bir organda immün yetmezlikle seyreden bloom sendromu geninin eksprese olması şaşırtıcı bir durum oluşturmaktadır. HClerde bloom sendrom geninin eksprese olduğunun belirlenmesinin immün hücre fonksiyonları açısından önemli olabileceği düşünülmektedir45,46.
HClerin timus medullasına özgü yapılar olduğu bilinmektedir. Geçmişte timustaki dejeneratif değişiklikleri içeren mezarlık alanları şeklinde bir tanımlamadan günümüzde sitokin ve büyüme faktörü üretimi aracılığıyla timusun temel işlevi olan lenfosit eğitimi ve farklılaşmasına büyük katkıda bulunan yapılar halinde açıklanmasıyla gerçekleşen dönüşüm HClerle ilgili önümüze yeni ufuklar açabilir. HC yapılarının bazı hastalıklarla yakından ilişkili olduğu ortaya konulmaya başlanmıştır. Bu da HC hastalık ilişkilerinin araştırıldığı yeni çalışmaların tasarlanmasının gelecekte büyük önem kazanabileceğini düşündürmektedir.



